2020年5月21日医疗器械技术审评中心公开征求“人因设计审查指导原则”意见,标志着人因设计在国内医疗器械行业有了监管基础。
01| 什么是医疗器械的人因设计?
医疗器械人因设计,也叫可用性工程,人因工程,是运用人类心理、生理等理论知识,设计医疗器械,使医疗器械更符合人的特性,保障医疗器械的安全、有效使用的过程。
02| 为什么要关注医疗器械的人因设计?
法规要求:欧盟、美国、中国的医疗器械管理机构制定了人因设计相关的法律标准和指导原则:要求二、三类医疗器械的生产企业或厂家在上市前必须进行人因设计评估并提交人因设计及使用错误评估报告;
提高开发效率和产品满意度:人因设计强调试错式开发,通过快速迭代方式,确定小化使用风险的方案。人因设计能够减少开发成本,提高产品开发效率,提升用户体验,提高用户满意度;
提高品牌形象:早期的人因设计流程,能够帮助企业发现潜在风险,降低医疗事故可能性,企业责任感和形象也得以提高。
03| 如何开展人因设计?
为了使得人因设计更容易实现,开展人因设计要遵循:
1个标准:IEC 62366-1:2015;
3个指南: IEC、FDA、NMPA提供的人因设计指南。
按照标准落实的医疗器械可用性,能同时满足中国、美国、欧盟对于医疗产品可用性的要求!
04| 如何具体落实标准?
为帮助广大医疗器械厂商,更好开展相关人因工程/可用性工程,帮助企业更好满足中国、美国、欧盟对可用性的相关要求,诺达思学院特开办2020年秋期,人因工程师在线培训课程,*免费!扫描下方二维码,了解课程详情。
本课程中您将获得:
国内外行业专家对于医疗器械人因工程的详尽培训;
医疗器械人因工程师培训证书;
人因工程可追溯性记录文件模板;
- 可用性测试*文档模板包;
授课单位:
诺达思总部位于荷兰瓦赫宁恩,拥有30年人因设计评估、实验室建设、设备提供经验,在79个国家有超过8000个客户。在中国、美国、德国、法国、西班牙、匈牙利等9个国家设有分公司和办事处。
服务企业包含医疗器械领域的,中国食品药品检定研究院、江苏省医疗器械检验所、TUV莱茵、飞利浦等,医药行业的强生、辉瑞、罗氏等,通信互联网等领域的,华为、微软、苹果、三星等。在产品人因和可用性领域有着深厚的经验积累。
授课对象:
包括但不限于,医疗器械相关研发总监/经理、研发质量经理/QA经理、注册经理/专员,设计师,风险管理工程师,及人因工程/可用性工程师,未来期望成为医疗器械可用性相关的从业人员。
授课时间:
2020年9月10日-2020年12月17日;
*开播时间:2020年9月10日,周四晚,20:30-21:30。
授课内容及方式:
本课程共8课时,为学员搭建医疗器械人因设计的基本知识框架,和实际操作指南。课程通过网络直播的方式进行授课。8课时的内容安排如下:
医疗器械人因工程概览和标准解读;
MDR\FDA\NMPA对于医疗器械可用性要求的区别;
"人因审查指导原则"中的人因设计流程;
人因实验室建设和测试设备使用指南;
人因设计核心要素收集方法;
人因设计确认方法与文档准备;
人因设计确认方法与实施要点;
准备人因设计研究资料的注意事项。
课程师资:
本课程由诺达思学院,医疗器械人因工程专家倾力打造,团队包含多位人因工程领域工作超过8年的人因工程专家。并邀请诺达思咨询顾问Henk作为客座讲师。
Henk Peels曾就职于飞利浦,bioMérieux,Organon Teknika等大型医疗器械公司,负责人因设计,具有20多年医疗器械人因工程经验。后又辅导过多家企业,帮助他们完善可用性工程、设计流程等。曾帮助医疗设备公司成功开发和发布医疗设备,从医疗点血液分析仪到实验室自动化和实验室检测设备,例如自动处理免疫分析和DNA的提取、分离和检测设备。
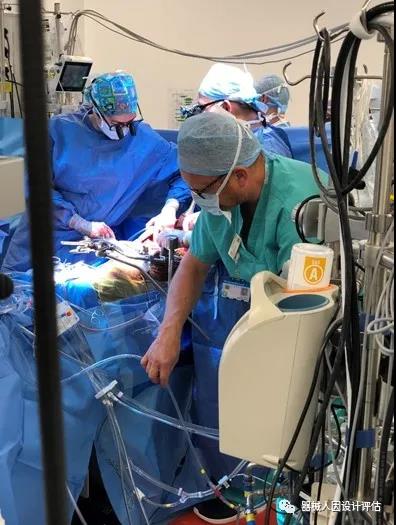
图为Henk在组织人工心肺机的总结性可用性测试。
课程收费:
本课程原价2899,现*98.8元。转发朋友圈,免费!
详情联系课程助手(扫码添加课程助手)

关注公众号获取更多课程信息!



